药品医疗器械改革方案出炉
导读: 医药产业中的多类老大难问题将被着手解决。 8月18日,中国政府网发布《国务院关于改革药品医疗器械审评审批制度的意见》(下称《意见》)。《意见》提出,严格控制市场供大于求药品的审批。争取2016年底前消化完积压存量,尽快实现注册申请和审评数量年度进出……
医药产业中的多类“老大难”问题将被着手解决。
8月18日,中国政府网发布《国务院关于改革药品医疗器械审评审批制度的意见》(下称《意见》)。《意见》提出,严格控制市场供大于求药品的审批。争取2016年底前消化完积压存量,尽快实现注册申请和审评数量年度进出平衡,2018年实现按规定时限审批。

药品医疗器械改革方案出炉
《意见》称,中国药品医疗器械审评审批中存在的问题日益突出,注册申请资料质量不高,,审评过程中需要多次补充完善,严重影响审评审批效率;仿制药重复建设、重复申请,市场恶性竞争,部分仿制药质量与国际先进水平存在较大差距;临床急需新药的上市审批时间过长,药品研发机构和科研人员不能申请药品注册,影响药品创新的积极性。
在新闻发布会上,国家食品药品监督管理总局副局长吴浈坦言,国家药品审评中心正在进行审评的有21000件药品,所有积压药品中,90%是化药仿制药,化学药品中80%以上是仿制药,仿制药的门槛低、申报量大,根据统计,100多个品种涉及的申报件就有2000多件。
药品审批标准提高
企业创新能力较弱,政策应在提高企业研发能力上想办法。
《意见》称“开展药品上市许可持有人制度试点”,允许药品研发机构和科研人员申请注册新药,在转让给企业生产时,只进行生产企业现场工艺核查和产品检验,不再重复进行药品技术审评。
为此《意见》还提出,加快法律法规修订,及时总结药品上市许可持有人制度试点、药品注册分类改革试点进展情况,推动加快修订《中华人民共和国药品管理法》,结合行政审批制度改革,抓紧按程序修订《中华人民共和国药品管理法实施条例》和《药品注册管理办法》等。
与其他行业相比,医药行业是高风险行业,一方面,新药研发周期长、耗资大,另一方面,即使新药上市,也未必有足够的市场认可率。另外,即便解决了药物研发问题,还有可能很多企业难以负担生产基地的建设等而拖累产业化,这使国内的研发团队也很难存活。
业内公认的方式是CMO(医药合同外包),但是目前,CMO在国内一直面临政策的紧箍咒。在现行法律法规下,药品上市许可与生产许可采取“捆绑”管理模式,药品批准文号只颁发给具有《药品生产许可证》的生产企业。这意味着研发类药企必须自建厂房,才能走完新药产业化的全流程,所以这块政策急需松动。
不少地方也在寻求机会试点。比如张江药谷,2013年6月,它与德国制药巨头勃林格殷格翰共同建设CMO(医药合同外包)生物制药基地,该项目去年6月启动,拟投入5亿元人民币。
另据前述药企研发负责人的说法,《意见》中还有不少亮点:组建专业化技术审评项目团队、全面公开药品医疗器械审评审批信息、对造假者进行严厉惩戒等,也有不少企业需要进一步明确的问题,比如,仿制药一致性评价的具体规则是怎么样的。
8月18日,中国政府网发布《国务院关于改革药品医疗器械审评审批制度的意见》(下称《意见》)。《意见》提出,严格控制市场供大于求药品的审批。争取2016年底前消化完积压存量,尽快实现注册申请和审评数量年度进出平衡,2018年实现按规定时限审批。

药品医疗器械改革方案出炉
在新闻发布会上,国家食品药品监督管理总局副局长吴浈坦言,国家药品审评中心正在进行审评的有21000件药品,所有积压药品中,90%是化药仿制药,化学药品中80%以上是仿制药,仿制药的门槛低、申报量大,根据统计,100多个品种涉及的申报件就有2000多件。
药品审批标准提高
企业创新能力较弱,政策应在提高企业研发能力上想办法。
《意见》称“开展药品上市许可持有人制度试点”,允许药品研发机构和科研人员申请注册新药,在转让给企业生产时,只进行生产企业现场工艺核查和产品检验,不再重复进行药品技术审评。
为此《意见》还提出,加快法律法规修订,及时总结药品上市许可持有人制度试点、药品注册分类改革试点进展情况,推动加快修订《中华人民共和国药品管理法》,结合行政审批制度改革,抓紧按程序修订《中华人民共和国药品管理法实施条例》和《药品注册管理办法》等。
与其他行业相比,医药行业是高风险行业,一方面,新药研发周期长、耗资大,另一方面,即使新药上市,也未必有足够的市场认可率。另外,即便解决了药物研发问题,还有可能很多企业难以负担生产基地的建设等而拖累产业化,这使国内的研发团队也很难存活。
业内公认的方式是CMO(医药合同外包),但是目前,CMO在国内一直面临政策的紧箍咒。在现行法律法规下,药品上市许可与生产许可采取“捆绑”管理模式,药品批准文号只颁发给具有《药品生产许可证》的生产企业。这意味着研发类药企必须自建厂房,才能走完新药产业化的全流程,所以这块政策急需松动。
不少地方也在寻求机会试点。比如张江药谷,2013年6月,它与德国制药巨头勃林格殷格翰共同建设CMO(医药合同外包)生物制药基地,该项目去年6月启动,拟投入5亿元人民币。
另据前述药企研发负责人的说法,《意见》中还有不少亮点:组建专业化技术审评项目团队、全面公开药品医疗器械审评审批信息、对造假者进行严厉惩戒等,也有不少企业需要进一步明确的问题,比如,仿制药一致性评价的具体规则是怎么样的。
文章部分文字、图片、数据、视频等内容信息来源于互联网,版权归原作者所有,如有侵权请立即联系删除。


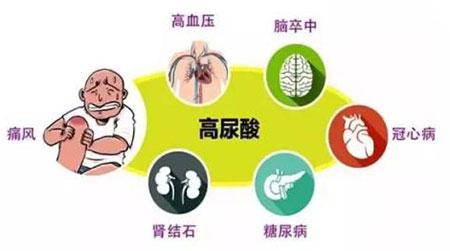

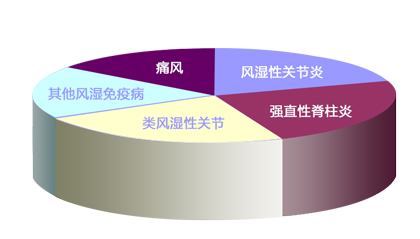

 河南郑州痛风医院提醒痛风发作时可别乱用抗生
河南郑州痛风医院提醒痛风发作时可别乱用抗生 肩周炎可以用哪些方法治?王怀庆专家为您介绍
肩周炎可以用哪些方法治?王怀庆专家为您介绍 河南治疗风湿医院介绍风湿性关节炎的治疗药有
河南治疗风湿医院介绍风湿性关节炎的治疗药有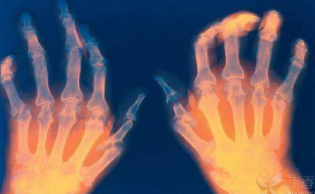 郑州类风湿医院简介类风湿性关节炎适宜运动吗
郑州类风湿医院简介类风湿性关节炎适宜运动吗 郑州痛风风湿病医院开启痛风发作、关节疼痛专场,享北京专家亲诊
郑州痛风风湿病医院开启痛风发作、关节疼痛专场,享北京专家亲诊 1.27-1.28!北京三甲教授来郑州痛风风湿病医院亲诊,痛风风湿病
1.27-1.28!北京三甲教授来郑州痛风风湿病医院亲诊,痛风风湿病 本周末北京大学人民医院专家在郑州痛风风湿病医院亲诊,领多项补
本周末北京大学人民医院专家在郑州痛风风湿病医院亲诊,领多项补