国务院印发关于改革药品医疗器械审批意见
导读: 新华社郑州8月18日电 经李克强总理签批,国务院日前印发《关于改革药品医疗器械审评审批制度的意见》(以下简称《意见》),明确药品医疗器械审评审批改革的目标、任务和具体措施。 《意见》指出,近年来,我国医药产业快速发展,药品医疗器械质量和标准不断……
新华社郑州8月18日电 经李克强总理签批,国务院日前印发《关于改革药品医疗器械审评审批制度的意见》(以下简称《意见》),明确药品医疗器械审评审批改革的目标、任务和具体措施。
《意见》指出,近年来,我国医药产业快速发展,药品医疗器械质量和标准不断提高,较好地满足了公众用药需要。与此同时,药品医疗器械审评审批中存在的问题也日益突出,主要是药品注册申报积压严重,一些创新药品上市审批时间过长,部分仿制药质量与国际先进水平存在较大差距。出现上述问题,有着深刻的历史、体制和机制等方面的原因。

党中央、国务院高度重视药品医疗器械审评审批制度改革,推进药品医疗器械审评审批制度改革,核心就是提高药品质量,主要目标是建立科学、高效的审评审批体系;2016年底前消化完注册申请积压存量,2018年实现按规定时限审批;力争2018年底前完成国家基本药物口服制剂与参比制剂质量和疗效一致性评价;开展药品上市许可持有人制度试点;提高审评审批透明度。通过改革,推动医药行业结构调整和转型升级,实现上市产品 性、安全性、质量可控性达到或接近国际水平,更好地满足公众用药需求。
《意见》明确了改革的12项任务,包括提高药品审批标准,推进仿制药质量一致性评价,加快创新药审评审批,开展药品上市许可持有人制度试点,落实申请人主体责任,及时发布药品供求和注册申请信息,改进药品临床试验审批,严肃查处注册申请弄虚作假行为,简化药品审批程序、完善药品再注册制度,改革医疗器械审批方式,健全审评质量控制体系,全面公开药品医疗器械审评审批信息。
为实现上述改革,国家食品药品监管总局将抓紧修订药品管理法实施条例及《药品注册管理办法》,面向社会招聘技术审评人才,加强审评队伍建设,推进职业化检查员队伍建设。
《意见》指出,近年来,我国医药产业快速发展,药品医疗器械质量和标准不断提高,较好地满足了公众用药需要。与此同时,药品医疗器械审评审批中存在的问题也日益突出,主要是药品注册申报积压严重,一些创新药品上市审批时间过长,部分仿制药质量与国际先进水平存在较大差距。出现上述问题,有着深刻的历史、体制和机制等方面的原因。

国务院印发关于改革药品医疗器械审批意见
我国曾经历过药品严重短缺的年代,现代制药业起步较晚,标准偏低。多年来,国家采取将地方审批药品集中到国家统一审批、药品标准由地方标准升国家标准、提高GMP认证水平、推进仿制药与原研药质量和疗效一致性评价等措施提高药品质量,但总体上仍然存在药品审批标准不高、管理方式落后、审评审批体制不顺、机制不合理等问题。企业低水平重复申报,部分注册申报临床数据不真实、不完整、不规范等问题比较突出。审评人员数量不足、待遇较低,与注册申报需求也不匹配。党中央、国务院高度重视药品医疗器械审评审批制度改革,推进药品医疗器械审评审批制度改革,核心就是提高药品质量,主要目标是建立科学、高效的审评审批体系;2016年底前消化完注册申请积压存量,2018年实现按规定时限审批;力争2018年底前完成国家基本药物口服制剂与参比制剂质量和疗效一致性评价;开展药品上市许可持有人制度试点;提高审评审批透明度。通过改革,推动医药行业结构调整和转型升级,实现上市产品 性、安全性、质量可控性达到或接近国际水平,更好地满足公众用药需求。
《意见》明确了改革的12项任务,包括提高药品审批标准,推进仿制药质量一致性评价,加快创新药审评审批,开展药品上市许可持有人制度试点,落实申请人主体责任,及时发布药品供求和注册申请信息,改进药品临床试验审批,严肃查处注册申请弄虚作假行为,简化药品审批程序、完善药品再注册制度,改革医疗器械审批方式,健全审评质量控制体系,全面公开药品医疗器械审评审批信息。
为实现上述改革,国家食品药品监管总局将抓紧修订药品管理法实施条例及《药品注册管理办法》,面向社会招聘技术审评人才,加强审评队伍建设,推进职业化检查员队伍建设。
文章部分文字、图片、数据、视频等内容信息来源于互联网,版权归原作者所有,如有侵权请立即联系删除。


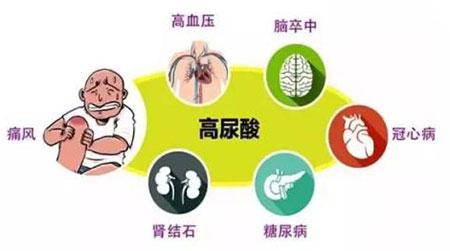

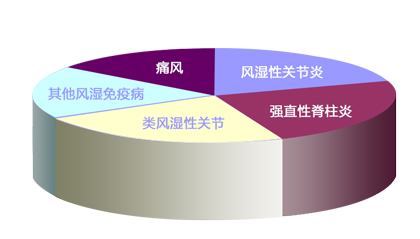

 河南郑州痛风医院提醒痛风发作时可别乱用抗生
河南郑州痛风医院提醒痛风发作时可别乱用抗生 肩周炎可以用哪些方法治?王怀庆专家为您介绍
肩周炎可以用哪些方法治?王怀庆专家为您介绍 河南治疗风湿医院介绍风湿性关节炎的治疗药有
河南治疗风湿医院介绍风湿性关节炎的治疗药有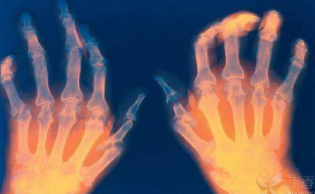 郑州类风湿医院简介类风湿性关节炎适宜运动吗
郑州类风湿医院简介类风湿性关节炎适宜运动吗 郑州痛风风湿病医院开启痛风发作、关节疼痛专场,享北京专家亲诊
郑州痛风风湿病医院开启痛风发作、关节疼痛专场,享北京专家亲诊 1.27-1.28!北京三甲教授来郑州痛风风湿病医院亲诊,痛风风湿病
1.27-1.28!北京三甲教授来郑州痛风风湿病医院亲诊,痛风风湿病 本周末北京大学人民医院专家在郑州痛风风湿病医院亲诊,领多项补
本周末北京大学人民医院专家在郑州痛风风湿病医院亲诊,领多项补